Enzim ( Pengertian, Sifat, Fungsi, Ciri-Ciri dan Mekanisme Kerja Enzim ), Enzim adalah biokatalisator yang banyak digunakan pada berbagai bidang industri produk pertanian, kimia, dan medis. Enzim memiliki sifat-sifat spesifik yang menguntungkan yaitu efisien, selektif, predictable, proses reaksi tanpa produk samping, dan ramah lingkungan. Sifat-sifat tersebut menyebabkan penggunaan enzim semakin meningkat dari tahun ke tahun, diperkirakan peningkatan mencapai 10–15% per tahun.
 |
| enzim |
1. Pengertian enzim
Enzim adalah biomolekul berupa protein yang berfungsi sebagai katalis (senyawa
yang mempercepat proses reaksi tanpa habis bereaksi) dalam suatu reaksi kimia organik. Molekul awal
yang disebut substrat akan
dipercepat perubahannya menjadi molekul lain yang disebut produk. Jenis produk
yang akan dihasilkan bergantung pada suatu kondisi/zat, yang disebut promoter. Semua
proses biologis selmemerlukan
enzim agar dapat berlangsung dengan cukup cepat dalam suatu arah lintasan metabolisme yang ditentukan oleh hormonsebagai
promoter.
Enzim adalah suatu biokatalisator, yaitu suatu bahan yang
berfungsi mempercepat reaksi kimia dalam tubuh makhluk hidup tetapi zat itu
sendiri tidak ikut bereaksi karena pada akhir reaksi terbentuk kembali. Suatu
reaksi kimia yang berlangsung dengan bantuan enzim memerlukan energi yang lebih
rendah. Jadi enzim juga berfungsi menurunkan energi aktivasi.
Enzim
bekerja dengan cara bereaksi dengan molekul substrat untuk menghasilkan
senyawa intermediat melalui
suatu reaksi kimia organik yang membutuhkan energi aktivasi lebih
rendah, sehingga percepatan reaksi kimia terjadi karena reaksi kimia dengan
energi aktivasi lebih tinggi membutuhkan waktu lebih lama.
Kerja enzim
dipengaruhi oleh beberapa faktor, terutama adalah substrat, suhu, keasaman, kofaktor dan inhibitor. Tiap enzim
memerlukan suhu dan pH (tingkat keasaman) optimum
yang berbeda-beda karena enzim adalah protein, yang dapat
mengalami perubahan bentuk jika suhu dan keasaman berubah. Di luar suhu atau pH
yang sesuai, enzim tidak dapat bekerja secara optimalatau
strukturnya akan mengalami kerusakan. Hal ini akan menyebabkan enzim kehilangan
fungsinya sama sekali. Kerja enzim juga dipengaruhi oleh molekul lain. Inhibitor adalah
molekul yang menurunkan aktivitas enzim, sedangkan aktivator adalah
yang meningkatkan aktivitas enzim. Banyak obat dan racun adalah
inihibitor enzim.
2. Fungsi Enzim
·
Menurunkan energi aktivasi
·
Mempercepat reaksi pada suhu dan tekanan tetap tanpa
mengubah besarnya tetapan seimbangnya
·
Mengendalikan reaksi
3. Sifat Enzim
·
Enzim merupakan biokatalisator yang mempercepat
jalannya reaksi tanpa ikut bereaksi.
·
Thermolabil. Mudah rusak bila dipanskan lebih dari 60°C
·
Merupakan senyawa protein, shingga sifat protein masih melekat
pada enzim
·
Dibutuhkan
dalam jumlah sedikit, sebagai biokatalisator, reaksi menjadi sangat cepat dan
berulang-ulang.
·
Bekerja didalam sel (endoenzim) dan diluar sel (ektoenzim)
Umumnya enzim bekerja mengkatalis reaksi satu arah, meskipun ada yang mengkatalis reaksi dua arah
Umumnya enzim bekerja mengkatalis reaksi satu arah, meskipun ada yang mengkatalis reaksi dua arah
·
Bekerjanya spesifik, karena sisi aktif enzim setangkup dengan
permukaan subtrat tertentu.
·
Umumnya enzim tidak dapat bekerja tampa adanya suatu zat non
protein tambahan yang disebut kofaktor
·
Enzim bersifat koloid, luas permukaan besar, bersifat hidrofil
·
Dapat bereaksi dengan senyawa asam maupun basa, kation maupun
anion
·
Enzim sangat peka terhadap faktor-faktor yang menyebabkan
denaturasi rotein misalnya suhu, pH dll
·
Enzim dapat dipacu maupun dihambat aktifitasnya
·
Enzim merupakan biokatalisator yang dalam jumlah sedikit memacu
laju reaksi tanpa merubah keseimbangan reaksi
·
Enzim tidak ikut terlibat dalam reaksi, struktur enzim tetap baik
sebelum maupun setelah reaksi berlangsung
·
Enzim bermolekul besar
·
Enzim bersifat khas/spesifik
·
Suhu: optimum 30°C, minimum 0°C, maksimum 40°C
·
Logam, memacu aktifitas enzim: Mg, Mn, Co, Fe
·
Logam berat, menghambat aktivitas enzim: Pb, Cu, Zn, Cd, Ag
·
pH, tergantung pada jenis enzimnya (pepsin aktif kondisi masam,
amilase kondisi netral, tripsin kondisi basa)
·
Konsentrasi substrat, substrat yang banyak mula-mula memacu
aktifitas enzim, tetapi kemudian menghambat karena: penumpukan produk (feed
back effect)
·
Konsentrasi enzim, peningkatan konsentrasi enzim memacu
aktifitasnya
·
Air, memacu aktifitas enzim
·
Vitamin, memacu aktifitas enzim
4. Ciri-ciri Enzim
1. Merupakan
sebuah protein. Jadi sifatnya sama dengan protein yaitu dapat
menggumpal dalam suhu tinggi dan terpengaruh oleh temperatur.
2. Bekerja
secara khusus. Artinya hanya untuk bekerja dalam satu reaksi
saja tidak dapat digunakan dalam beberapa reaksi.
3. Dapat
digunakan berulang kali. Enzim dapat digunakan berulang kali karena enzim
tidak berubah pada saat terjadi reaksi.
4. Rusak oleh
panas. Enzim tidak tahan pada suhu tinggi, kebanyakan enzim hanya bertahan
pada suhu 500C, rusaknya enzim oleh panas disebut dengan
denaturasi,
5. Dapat
bekerja bolak – balik. Artinya satu enzim dapat menguraikan satu
senyawa menjadi senyawa yang lain.
5. Isozim
Isozim atau
Iso-enzim adalah dalam suatu campuran terdapat lebih dari satu enzim yang dapat
berperan dalam suatu substrat untuk memberikan suatu hasil yang sama. Keuntungan
bagi tumbuhan yang mengandung isoenzim adalah karena isozim – isozim tersebut
akan memiliki tanggapan yang berbeda terhadap faltor – faktor lingkungan.
Setiap isozim dihadapkan pada lingkungan kimia yang berbeda dab masing – masing
berperan pada posisi yang berbeda dalam lintasan metabolik.
Enzim tersusun atas dua bagian. Apabila enzim dipisahkan
satu sama lainnya menyebabkan enzim tidak aktif. Namun keduanya dapat
digabungkan menjadi satu, yang disebut holoenzim. Kedua bagian enzim tersebut
yaitu apoenzim dan koenzim.
1. Apoenzim
Apoenzim adalah bagian protein dari
enzim, bersifat tidak tahan panas, dan berfungsi menentukan kekhususan dari
enzim. Contoh, dari substrat yang sama dapat menjadi senyawa yang berlainan,
tergantung dari enzimnya.
2. Koenzim
Koenzim disebut gugus prostetik
apabila terikat sangat erat pada apoenzim. Akan tetapi, koenzim tidak begitu
erat dan mudah dipisahkan dari apoenzim. Koenzim bersifat termostabil (tahan
panas), mengandung ribose dan fosfat. Fungsinya menentukan sifat dari
reaksinya. Misalnya, Apabila koenzim NADP (Nicotiamida Adenin Denukleotid
Phosfat) maka reaksi yang terjadi adalah dehidrogenase. Disini NADP berfungsi
sebagai akseptor hidrogen. Model pengisian ruang koenzim NADH. Koenzim dapat bertindak sebagai
penerima/akseptor hidrogen, seperti NAD atau donor dari gugus kimia, seperti AT
P (Adenosin Tri Phosfat).
6. Faktor yang mempengaruhi kerja enzim
· Temperatur atau suhu
Umumnya enzim bekerja
pada suhu yang optimum. Apabila suhu turun, maka aktivitas akan terhenti
tetapi enzim tidak rusak. Sebaliknya, pada suhu tinggi aktivitas
menurun dan enzim menjadi rusak.
·
Air
Air berperan dalam
memulai kegiatan enzim. Contoh pada waktu biji dalam keadaan kering
kegiatan enzim tidak kelihatan. Baru setelah ada air, melalui imbibisi
mu-lailah biji berkecambah.
·
pH
Perubahan pH dapat
membalikkan kegiatan enzim, yaitu mengubah hasil akhir kembali menjadi
substrat.
·
Hasil akhir
Kecepatan reaksi
dalam suatu proses kimia tidak selalu konstan. Misal, kegiatan pada awal
reaksi tidak sama dengan kegiatan pada pertengahan atau akhir reaksi.
Apabila hasil akhir (banyak), maka akan menghambat aktivitas enzim.
·
Substrat
Substrat adalah zat
yang diubah menjadi sesuatu yang baru. Umumnya, terdapat hubungan yang
sebanding antara substrat dengan hasil akhir apabila
konsentrasi enzim tetap, pH konstan, dan temperatur konstan.
Jadi, apabila substrat yang tersedia dua kali lipat, maka hasil akhir
juga dua kali lipat.
· Zat-zat penghambat
Zat-zat
penghambat adalah zat-zat kimia yang menghambat aktivitas kerja enzim.
Contoh, garam-garam dari logam berat, seperti raksa.
7. Tata Nama Enzim
Nama enzim
sering kali diturunkan dari nama substrat ataupun reaksi kimia yang ia
kataliskan dengan akhiran -ase.
Contohnya adalah laktase, alkohol dehidrogenase (mengatalisis penghilangan
hidrogen dari alkohol), dan DNA polimerase.
International Union of
Biochemistry and Molecular Biology telah
mengembangkan suatu tatanama untuk enzim, yang disebut sebagai nomor EC; tiap-tiap
enzim memiliki empat digit nomor urut sesuai dengan ketentuan klasifikasi yang
berlaku.
Nomor
pertama untuk klasifikasi teratas enzim didasarkan pada ketentuan berikut:
· EC 1 Oksidoreduktase:
mengatalisis reaksi oksidasi/reduksi
· EC 2 Transferase:
mentransfer gugus fungsi
· EC 3 Hidrolase:
mengatalisis hidrolisis berbagai
ikatan
· EC 4 Liase: memutuskan
berbagai ikatan kimia selain melalui hidrolisis dan oksidasi
· EC 5 Isomerase:
mengatalisis isomerisasi sebuah
molekul tunggal
· EC 6 Ligase:
menggabungkan dua molekul dengan ikatan kovalen
Menurut
IUBMB (International Union of Biochemistry and Molecular Biology), enzim-enzim
dikelompokkan menjadi 6 golongan atau kelas, sebagaimana yang disajikan dalam
tabel 3-3. Masing-masing kelas ini dikelompok-kelompokkan lagi menjadi beberapa
subkelas. Misalnya, enzim kelas (1) yaitu kelas Oksidoreduktase, dibagi menjadi
beberapa subkelas, antara lain subkelas (1) yaitu enzim oksidoreduktase yang
bekerja pada gugus CH-OH donor dan subkelas (2) yaitu enzim yang bekerja pada
gugus aldehida atau gugus okso senyawa donor, dan lain-lain. Demikian pula
enzim kelas (2), (3), (4) dan selanjutnya, masing-masing juga dibagi-bagi lagi
menjadi beberapa subkelas.
Kemudian,
masing-masing subkelas juga masih dibagi-bagi lagi menjadi beberapa
sub-subkelas. Misal, enzim subkelas (1) dari kelas (1)
yaitu enzim oksidoreduktase yang bekerja pada gugus CH-OH donor, dibagi lagi
menjadi beberapa sub-subkelas, antara lain sub-subkelas (1) yaitu yang bekerja
dengan NAD or NADP sebagai akseptor dan sub-subkelas (2) yaitu yang
bekerja dengan sitokrom sebagai akseptor. Masing-masing sub-subkelas ini
beranggotakan beberapa enzim yang memenuhi kriteria dalam pengelompokannya.
Untuk
memudahkan memahami pembagian enzim ini dapat dilihat skemanya pada Tabel ;
No.
|
Kelompok/Kelas
|
Sifat
Biokimia
|
1.
|
Oksidoreduktase
|
Mengkatalisis reaksi
reduksi-oksidasi terhadap berbagai gugus
|
2.
|
Transferase
|
Mengkatalisis
berbagai reaksi transfer gugus fungsional dari molekul donor ke molekul
akseptornya. Salah satu subkelompok enzim transferase adalah enzim-enzim
kinase yang mengendalikan metabolisme dengan jalan mentransfer gugus fosfat
dari ATP ke molekul lain.
|
3.
|
Hidrolase
|
Mengkatalisis reaksi
penambahan molekul air pada suatu ikatan, yang kemudian dilanjutkan dengan
reaksi penguraian (hidrolisis)
|
4.
|
Liase
|
Mengkatalisis reaksi
penambahan molekul air, ammonia atau karbon dioksida pada suatu ikatan
rangkap, atau melepaskan air, ammonia, atau karbon dioksida dan membentuk
ikatan rangkap.
|
5.
|
Isomerase
|
Mengkatalisis
berbagai reaksi isomerisasi, antara lain isomerisasi L menjadi D, reaksi
mutasi (perpindahan posisi suatu gugus), dan lain-lain.
|
6.
|
Ligase
|
Mengkatalisis reaksi
dimana dua gugus kimia disatukan atau diikatkan (ligasi) dengan menggunakan
energi yang berasal dari ATP.
|
8. Enzim berdasarkan Tempat Kerjanya
a. Endoenzim
Endoenzim
disebut juga enzim intraseluler, yaitu enzim yang bekerjanya di dalam sel.
Umumnya merupakan enzim yang digunakan untuk proses sintesis di dalamsel dan
untuk pembentukan energi (ATP) yang berguna untuk proses kehidupan sel,misal
dalam proses respirasi.
b. Eksoenzim
Eksoenzim
disebut juga enzim ekstraseluler, yaitu enzim yang bekerjanya di luar sel.
Umumnya berfungsi untuk “mencernakan” substrat secara hidrolisis, untuk
dijadikan molekul yang lebih sederhana dengan BM lebih rendah sehingga dapat
masuk melewati membran sel. Energi yang dibebaskan pada reaksi pemecahan
substrat di luar sel tidak digunakan dalam proses kehidupan sel.
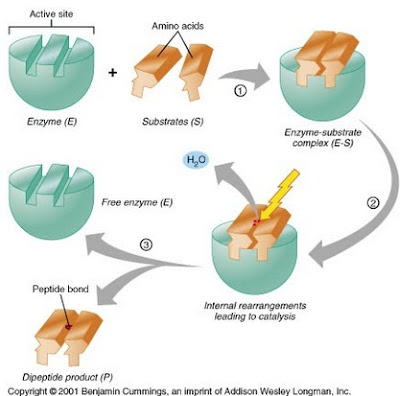
9. Mekanisme Kerja Enzim
Produksi
enzim dilakukan oleh sel, berdasarkan instruksi dari gen sel itu. Jadi cacat
pada gen dapat mengakibatkan enzim rusak, yang tidak bekerja dengan baik.
Struktur dan fungsi masing-masing enzim berbeda. Mereka harus bertindak atas
target yang berbeda, yang bervariasi dari satu enzim ke enzim lainnya.
Biasanya, enzim tertentu dapat bertindak atas target tertentu saja. The
tindakan enzim berbeda dan kompleks dan sebagainya, ada berbagai teori tentang
subjek ini.
Secara
umum, mekanisme kerja enzim dapat digambarkan sebagai berikut. Setiap enzim
bertindak atas target tertentu yang disebut substrat, yang diubah menjadi
produk yang dapat digunakan melalui aksi enzim. Dengan kata lain, enzim
bereaksi dengan substrat membentuk kompleks enzim-substrat. Setelah reaksi
selesai, enzim tetap sama, tapi substrat mengubah produk. Misalnya, sukrase
tindakan enzim pada substrat sukrosa untuk membentuk produk - fruktosa dan
glukosa.
Teori
lock and key: Ini adalah salah satu teori yang menjelaskan mekanisme kerja
enzim. Sesuai teori ini, masing-masing enzim memiliki area spesifik (disebut
situs aktif) yang dimaksudkan untuk substrat tertentu untuk mendapatkan
terpasang. Situs aktif enzim ini melengkapi bagian tertentu dari substrat, sejauh
bentuk yang bersangkutan. Substrat akan masuk ke dalam situs aktif dengan
sempurna, dan reaksi antara mereka terjadi.
 |
| Mekanisme Kerja Enzim |
Substrat
yang tepat akan masuk ke dalam situs aktif enzim dan membentuk kompleks
enzim-substrat. Ini adalah di situs ini aktif bahwa substrat ditransformasikan
ke produk yang dapat digunakan. Setelah reaksi selesai, dan produk yang
dirilis, situs aktif tetap sama dan siap untuk bereaksi dengan substrat baru.
Teori ini didalilkan oleh Emil Fischer pada tahun 1894. Teori ini memberikan
gambaran dasar tentang aksi enzim pada substrat. Namun, ada faktor-faktor
tertentu yang tetap tidak dapat dijelaskan. Sesuai teori ini, asam amino (dalam
keadaan terikat) di situs aktif bertanggung jawab untuk bentuk spesifik. Ada
enzim tertentu yang tidak membentuk bentuk apapun dalam bentuk terikat. Kunci
dan teori kunci gagal untuk menjelaskan aksi enzim tersebut.
Teori
Induced-fit: Teori ini dirumuskan oleh Daniel E. Koshland, Jr pada tahun 1958.
Teori ini juga mendukung hipotesis gembok dan kunci bahwa situs aktif dan
substrat cocok dan bentuk mereka saling melengkapi. Menurut teori-induced fit,
bentuk situs aktif tidak kaku. Hal ini fleksibel dan perubahan, sebagai
substrat datang ke dalam kontak dengan enzim.
Untuk
lebih tepatnya, sekali enzim mengidentifikasi substrat yang tepat, bentuk
perubahan situs aktifnya sehingga muat kedua persis. Hal ini menyebabkan
pembentukan kompleks enzim-substrat dan reaksi lebih lanjut. Seperti teori ini
menjelaskan mekanisme kerja berbagai enzim, itu diterima secara luas daripada
kunci dan hipotesis kunci.
Faktor-faktor yang Mempengaruhi
Aksi Enzim ': Aktivitas enzim dipengaruhi oleh berbagai faktor, seperti suhu,
pH, dan konsentrasi. Biasanya, suhu tinggi meningkatkan laju reaksi yang
melibatkan enzim. Suhu optimal untuk reaksi tersebut dikatakan sekitar 37 º C
sampai 40 º C. Setelah suhu naik di atas tingkat ini, enzim mendapatkan
terdenaturasi dan mereka tidak lagi cocok untuk reaksi dengan substrat. Variasi
pH juga dapat mempengaruhi mekanisme kerja enzim. Tingkat pH optimum dapat
bervariasi dari satu enzim yang lain, sesuai dengan lokasi aksi mereka. Variasi
dari tingkat pH dapat memperlambat aktivitas enzim dan hasil pH yang sangat
tinggi atau rendah dalam enzim terdenaturasi yang tidak dapat memegang substrat
dengan benar. Tingkat aktivitas enzimatik dapat meningkat dengan konsentrasi
enzim dan substrat.
9. Enzim dalam proses metabolism
1. Enzim katalase
Enzim katalase
berfungsi membantu pengubahan hidrogen peroksida menjadi air dan oksigen.
2. Enzim oksidase
Enzim oksidase
berfungsi mempergiat penggabungan O2 dengan suatu substrat yang pada saat
bersamaan juga mereduksikan O2, sehingga terbentuk H2O.
3. Enzim hidrase
Enzim hidrase
berfungsi menambah atau mengurangi air dari suatu senyawa tanpa
menyebabkan terurainya senyawa yang bersangkutan. Contoh: fumarase,
enolase, akonitase.
4. Enzim dehidrogenase
Enzim
dehidrogenase berfungsi memindahkan hidrogen dari suatu zat ke zat yang
lain.
5. Enzim transphosforilase
Enzim
transphosforilase berfungsi memindahkan H3PO4 dari molekul satu ke molekul
lain dengan bantuan ion Mg2+.
6. Enzim karboksilase
Enzim
karboksilase berfungsi dalam pengubahan asam organik secara bolak-balik.
Contoh pengubahan asam piruvat menjadi asetaldehida dibantu oleh
karboksilase piruvat.
7. Enzim desmolase
Enzim
desmolase berfungsi membantu dalam pemindahan atau penggabungan ikatan
karbon. Contohnya, aldolase dalam pemecahan fruktosa menjadi
gliseraldehida dan dehidroksiaseton.
8. Enzim peroksida
Enzim
peroksida berfungsi membantu mengoksidasi senyawa fenolat, sedangkan
oksigen yang dipergunakan diambil dari H2O2.







