3 Proses Penyembuhan Luka - Ada tiga fase dalam proses penyembuhan luka, dimana ketiganya saling tumpang tindih, yaitu fase inflamasi, proliferasi dan remodeling (Lorenz, Longaker, 2006). Pada setiap fase penyembuhan tersebut terdapat satu jenis sel khusus yang mendominasi. Fase awal yakni fase inflamasi dimulai segera setelah terjadinya suatu cidera, dengan tujuan untuk menyingkirkan jaringan mati dan mencegah infeksi. Fase proliferasi berlangsung kemudian, di mana akan terjadi keseimbangan antara pembentukan jaringan parut dan regenerasi jaringan. Fase yang paling akhir merupakan fase terpanjang dan hingga saat ini merupakan fase yang paling sedikit dipahami, yaitu fase remodeling yang bertujuan untuk memaksimalkan kekuatan dan integritas struktural dari luka (Gurtner, 2007).
Pembagian fase penyembuhan luka pada respon normal mamalia yang mengalami defek akibat kerusakan integritas kulit yang terjadi adalah fase inflamasi, fase proliferasi dan fase maturasi.
1. Fase inflamasi (lag phase)
Pada fase inflamasi terjadi proses hemostasis yang cepat dan dimulainya suatu siklus regenerasi jaringan (Lorenz, Longaker, 2006). Fase inflamasi dimulai segera setelah cidera sampai hari ke-5 pasca cidera. Tujuan utama fase ini adalah hemostasis, hilangnya jaringan yang mati dan pencegahan kolonisasi maupun infeksi oleh agen mikrobial patogen (Gurtner, 2007).
Komponen jaringan yang mengalami cidera, meliputi fibrillar collagen dan tissue factor, akan mengaktivasi jalur koagulasi ekstrinsik dan mencegah perdarahan lebih lanjut pada fase ini. Pembuluh darah yang cidera mengakibatkan termobilisasinya berbagai elemen darah ke lokasi luka. Agregasi platelet akan membentuk plak pada pembuluh darah yang cidera. Selama proses ini berlangsung, platelet akan mengalami degranulasi dan melepaskan beberapa growth factor, seperti platelet-derived growth factor (PDGF) dan transforming growth factor-β (TGF-β). Hasil akhir kaskade koagulasi jalur intrinsik dan ekstrinsik adalah konversi fibrinogen menjadi fibrin (Gurtner, 2007). Berbagai mediator inflamasi yakni prostaglandin, interleukin-1 (IL-1), tumor necrotizing factor (TNF), C5a, TGF-βdan produk degradasi bakteri seperti lipopolisakarida (LPS) akan menarik sel netrofil sehingga menginfiltrasi matriks fibrin dan mengisi kavitas luka. Migrasi netrofil ke luka juga dimungkinkan karena peningkatan permeabilitas kapiler akibat terlepasnya serotonin dan histamin oleh mast cell dan jaringan ikat. Netrofil pada umumnya akan ditemukan pada 2 hari pertama dan berperan penting untuk memfagositosis jaringan mati dan mencegah infeksi. Keberadaan netrofil yang berkepanjangan merupakan penyebab utama terjadinya konversi dari luka akut menjadi luka kronis yang tak kunjung sembuh (Regan, Barbul, 1994; Gurtner, 2007).
Makrofag juga akan mengikuti netrofil menuju luka setelah 48-72 jam dan menjadi sel predominan setelah hari ke-3 pasca cidera. Debris dan bakteri akan difagositosis oleh makrofag. Makrofag juga berperan utama memproduksi berbagai growth factor yang dibutuhkan dalam produksi matriks ekstraseluler oleh fibroblas dan pembentukan neovaskularisasi. Keberadaan makrofag oleh karenanya sangat penting dalam fase penyembuhan ini (Gurtner, 2007). Limfosit dan mast cell merupakan sel terakhir yang bergerak menuju luka dan dapat ditemukan pada hari ke-5 sampai ke-7 pasca cidera. Peran keduanya masih belum jelas hingga saat ini (Gurtner, 2007).
Fase ini disebut juga lag phase atau fase lamban karena reaksi pembentukan kolagen baru sedikit, belum ada tensile strength, di mana pertautan luka hanya dipertahankan oleh fibrin dan fibronektin (Regan, Barbul, 1994). Sel punca mesenkim akan bermigrasi ke luka, membentuk sel baru untuk regenerasi jaringan baik tulang, kartilago, jaringan fibrosa, pembuluh darah, maupun jaringan lain. Fibroblas akan bermigrasi ke luka dan mulai berproliferasi menghasilkan matriks ekstraseluler. Sel endotel pembuluh darah di daerah sekitar luka akan berproliferasi membentuk kapiler baru untuk mencapai daerah luka. Ini akan menandai dimulainya proses angiogenesis. Pade akhir fase inflamasi, mulai terbentuk jaringan granulasi yang berwarna kemerahan, lunak dan granuler. Jaringan granulasi adalah suatu jaringan kaya vaskuler, berumur pendek, kaya fibroblas, kapiler dan sel radang tetapi tidak mengandung ujung saraf (Anderson, 2000).
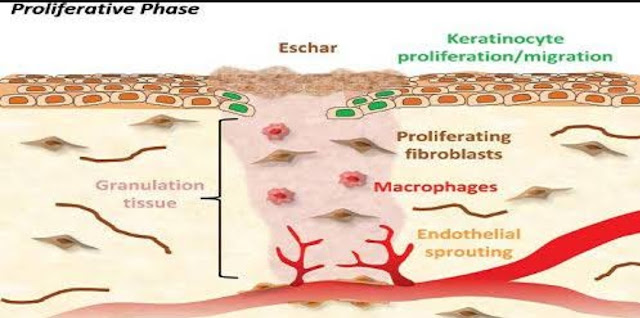
2. Fase proliferasi (fibroplasi, regenerasi)
Fase proliferasi berlangsung mulai hari ke-4 hingga hari ke-21 pasca cidera. Keratinosit yang berada pada tepi luka sesungguhnya telah mulai bekerja beberapa jam pasca cidera, menginduksi terjadinya reepitelialisasi. Pada fase ini matriks fibrin yang didominasi oleh platelet dan makrofag secara gradual digantikan oleh jaringan granulasi yang tersusun dari kumpulan fibroblas, makrofag dan sel endotel yang membentuk matriks ekstraseluler dan neovaskular (Gurtner, 2007).
Faktor setempat seperti growth factor, sitokin, hormon, nutrisi, pH dan tekanan oksigen sekitar menjadi perantara dalam proses diferensiasi sel punca (Anderson, 2000). Regresi jaringan desmosom antar keratinosit mengakibatkan terlepasnya keratinosit untuk bermigrasi ke daerah luka. Keratinosit juga bermigrasi secara aktif karena terbentuknya filamen aktin di dalam sitoplasma keratinosit. Keratinosit bermigrasi akibat interaksinya dengan protein sekretori seperti fibronektin, vitronektin dan kolagen tipe I melalui perantara integrin spesifik di antara matriks temporer. Matriks temporer ini akan digantikan secara bertahap oleh jaringan granulasi yang kaya akan fibroblas, makrofag dan sel endotel. Sel tersebut akan membentuk matriks ekstraseluler dan pembuluh darah baru. Jaringan granulasi umumnya mulai dibentuk pada hari ke-4 setelah cidera (Lorenz, Longaker, 2006).
Fibroblas merupakan sel utama selama fase ini dimana ia menyediakan kerangka untuk migrasi keratinosit. Makrofag juga akan menghasilkan growth factor seperti PDGF dan TGF-β yang akan menginduksi fibroblas untuk berploriferasi, migrasi dan membentuk matriks ekstraseluler. Matriks temporer ini secara bertahap akan digantikan oleh kolagen tipe III. Sel endotel akan membentuk pembuluh darah baru dengan bantuan protein sekretori VEGF, FGF dan TSP-1. Pembentukan pembuluh darah baru dan jaringan granulasi merupakan tanda penting fase proliferasi karena ketiadaannya pembuluh darah baru dan atau jaringan granulasi merupakan tanda dari gangguan penyembuhan luka. Setelah kolagen mulai menggantikan matriks temporer, fase proliferasi mulai berhenti dan fase remodeling mulai berjalan (Gurtner, 2007). Faktor proangiogenik yang diproduksi makrofag seperti vascular endothelial growth factor (VEGF), fibroblas growth factor (FGF)-2, angiopoietin- 1 dan thrombospondin akan menstimulasi sel endotel membentuk neovaskular melalui proses angiogenesis. Hal yang menarik dari fase proliferasi ini adalah bahwa pada suatu titik tertentu, seluruh proses yang telah dijabarkan di atas harus dihentikan. Fibroblas akan segera menghilang segera setelah matriks kolagen mengisi kavitas luka dan pembentukan neovaskular akan menurun melalui proses apoptosis. Kegagalan regulasi pada tahap inilah yang hingga saat ini dianggap sebagai penyebab terjadinya kelainan fibrosis seperti jaringan parut hipertrofik (Gurtner, 2007).
3. Fase maturasi (remodeling)
Fase ketiga dan terakhir adalah fase remodeling. Selama fase ini jaringan baru yang terbentuk akan disusun sedemikian rupa seperti jaringan asalnya. Fase maturasi ini berlangsung mulai hari ke-21 hingga sekitar 1 tahun. Fase ini segera dimulai segera setelah kavitas luka terisi oleh jaringan granulasi dan proses reepitelialisasi usai. Perubahan yang terjadi adalah penurunan kepadatan sel dan vaskularisasi, pembuangan matriks temporer yang berlebihan dan penataan serat kolagen sepanjang garis luka untuk meningkatkan kekuatan jaringan baru. Fase akhir penyembuhan luka ini dapat berlangsung selama bertahun-tahun (Gurtner, 2007).
Kontraksi dari luka dan remodeling kolagen terjadi pada fase ini. Kontraksi luka terjadi akibat aktivitas miofibroblas, yakni fibroblas yang mengandung komponen mikrofilamen aktin intraselular. Kolagen tipe III pada fase ini secara gradual digantikan oleh kolagen tipe I dengan bantuan matrix metalloproteinase (MMP) yang disekresi oleh fibroblas, makrofag dan sel endotel. Sekitar 80% kolagen pada kulit adalah kolagen tipe I yang memungkinkan terjadinya tensile strength pada kulit (Gurtner, 2007). Keseimbangan antara proses sintesis dan degradasi kolagen terjadi pada fase ini. Kolagen yang berlebihan didegradasi oleh enzim kolagenase dan kemudian diserap. Sisanya akan mengerut sesuai tegangan yang ada. Hasil akhir dari fase ini berupa jaringan parut yang pucat, tipis, lemas dan mudah digerakkan dari dasarnya. Kolagen awalnya tersusun secara tidak beraturan, sehingga membutuhkan lysyl hydroxylase untuk mengubah lisin menjadi hidroksilisin yang dianggap bertanggung jawab terhadap terjadinya cross-linking antar kolagen. Cross-linking inilah yang menyebabkan terjadinya tensile strength sehingga luka tidak mudah terkoyak lagi. Tensile strength akan bertambah secara cepat dalam 6 minggu pertama, kemudian akan bertambah perlahan selama 1-2 tahun. Pada umumnya tensile strength pada kulit dan fascia tidak akan pernah mencapai 100%, namun hanya sekitar 80% dari normal (Hidayat, 2013)
Metaloproteinase matriks yang disekresi oleh makrofag, fibroblas dan sel endotel akan mendegradasi kolagen tipe III. Kekuatan jaringan parut bekas luka akan semakin meningkat akibat berubahnya tipe kolagen dan terjadinya crosslinking jaringan kolagen. Pada akhir fase remodeling, jaringan baru hanya akan mencapai 70% kekuatan jaringan awal (Gurtner, 2007).